Chứng nhận ANVISA Brasil
PCN do Brasil là chi nhánh của công ty chúng tôi tại thị trường Mỹ la tinh, được cơ quan Cgcre-Inmetro/IAF công nhận là Tổ chức Chứng nhận theo phạm vi sản phẩm của số công nhận nº OCP 0104:

Thiết bị gia dụng - An toàn, Năng lượng và EMC
Inmetro Ordinance 371/2009
IEC 60335-1 Series
Thiết bị chiếu sáng – An toàn, EMC và Hiệu quả năng lượng
Inmetro Ordinance RTQ 144/2012
IEC 62031/2013
IEC 62560/2013
IEC 62612/2013
CISPR 15
Các thiết bị y tế
IEC 60601 Series + Syringes / Needles / Infusion Sets
Thiết bị viễn thông
Categories I, II and III
Inmetro Ordinance 371/2009
IEC 60335-1 Series
Thiết bị chiếu sáng – An toàn, EMC và Hiệu quả năng lượng
Inmetro Ordinance RTQ 144/2012
IEC 62031/2013
IEC 62560/2013
IEC 62612/2013
CISPR 15
Các thiết bị y tế
IEC 60601 Series + Syringes / Needles / Infusion Sets
Thiết bị viễn thông
Categories I, II and III
Chứng nhận ANVISA
Agencia Naciona Vigilancia Sanitaria : Cơ quan quản lý y tế Brazil (ANVISA)
Tùy thuộc vào mặt hàng, chứng nhận thiết bị y tế của Brazil được chia thành chứng nhận bắt buộc và không bắt buộc. Hệ thống phân loại thiết bị y tế của Brazil tương tự như quy định cơ bản 93/42/EEC của Châu Âu. ANVISA yêu cầu các nhà sản xuất thiết bị y tế phải tuân thủ Thực hành Sản xuất Tốt (GMP) của Brazil và yêu cầu thêm chứng nhận INMETRO đối với các thiết bị chạy bằng điện.
Cơ quan được ủy quyền cấp chứng nhận sản phẩm, được gọi là Cơ quan Chứng nhận Sản phẩm (Organismos de Certificação de Produto - OCP), phải được CGCRE công nhận, dựa trên các nguyên tắc và chính sách được áp dụng trong SBAC.
Việc lựa chọn phòng thử nghiệm tuân theo quy tắc được xác định trong Quy định đánh giá sự phù hợp, nhưng ưu tiên thực hiện các thử nghiệm trong các phòng thí nghiệm được CGCRE công nhận.
Để nhập khẩu hoặc bán thiết bị y tế ở Brazil, nhà sản xuất hoặc nhà nhập khẩu phải thực hiện quy trình đăng ký thiết bị y tế với ANVISA và phải có BRH (Brazilian Registration Holder). Tùy thuộc vào mức độ rủi ro của sản phẩm, nó được chia thành 4 loại khác nhau.
Sản phẩm mục tiêu:
Tất cả các thiết bị y tế đều phải đăng ký và được phân loại là Loại I, Loại II, Loại III hoặc Loại IV (Nghị quyết RDC 185/2001 của Brazil)
- Loại I: Các sản phẩm không có khả năng gây rủi ro cho người dùng hoặc sức khỏe cộng đồng và chỉ yêu cầu đăng ký tóm tắt ANVISA
- Loại 2 (Loại II): Các sản phẩm có khả năng gây rủi ro cho người dùng hoặc sức khỏe cộng đồng và cần phải đăng ký chính thức với ANVISA
- Loại 3 (Classe III): Sản phẩm có khả năng gây rủi ro rất cao cho người dùng hoặc sức khỏe cộng đồng cần phải đăng ký chính thức với ANVISA
- Nhóm 3-a (Loại IV): Mặt hàng yêu cầu kiểm tra tự động và phải đăng ký chính thức với ANVISA
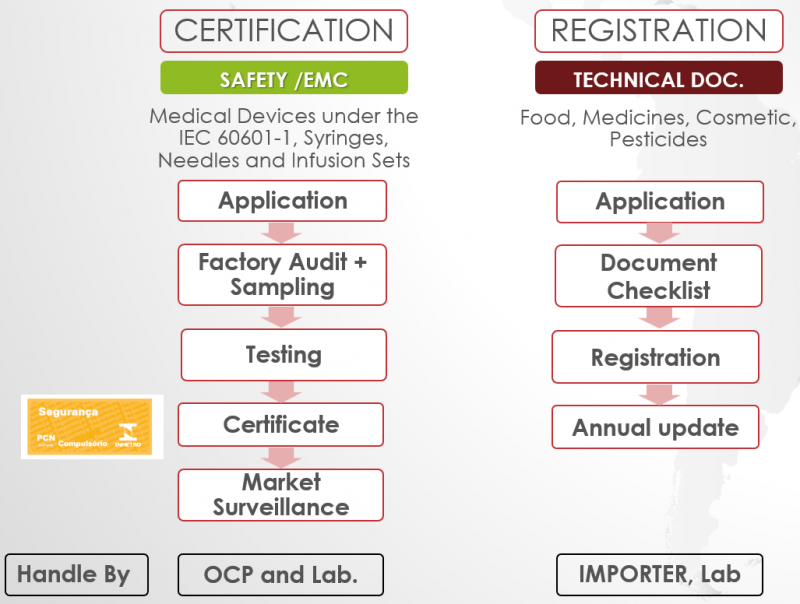
Dưới đây là quy trình chứng nhận chung các sản phẩm thuộc danh mục Chứng nhận và Đăng ký ANVISA:
Agencia Naciona Vigilancia Sanitaria : Cơ quan quản lý y tế Brazil (ANVISA)
Tùy thuộc vào mặt hàng, chứng nhận thiết bị y tế của Brazil được chia thành chứng nhận bắt buộc và không bắt buộc. Hệ thống phân loại thiết bị y tế của Brazil tương tự như quy định cơ bản 93/42/EEC của Châu Âu. ANVISA yêu cầu các nhà sản xuất thiết bị y tế phải tuân thủ Thực hành Sản xuất Tốt (GMP) của Brazil và yêu cầu thêm chứng nhận INMETRO đối với các thiết bị chạy bằng điện.
Cơ quan được ủy quyền cấp chứng nhận sản phẩm, được gọi là Cơ quan Chứng nhận Sản phẩm (Organismos de Certificação de Produto - OCP), phải được CGCRE công nhận, dựa trên các nguyên tắc và chính sách được áp dụng trong SBAC.
Việc lựa chọn phòng thử nghiệm tuân theo quy tắc được xác định trong Quy định đánh giá sự phù hợp, nhưng ưu tiên thực hiện các thử nghiệm trong các phòng thí nghiệm được CGCRE công nhận.
Để nhập khẩu hoặc bán thiết bị y tế ở Brazil, nhà sản xuất hoặc nhà nhập khẩu phải thực hiện quy trình đăng ký thiết bị y tế với ANVISA và phải có BRH (Brazilian Registration Holder). Tùy thuộc vào mức độ rủi ro của sản phẩm, nó được chia thành 4 loại khác nhau.
Sản phẩm mục tiêu:
Tất cả các thiết bị y tế đều phải đăng ký và được phân loại là Loại I, Loại II, Loại III hoặc Loại IV (Nghị quyết RDC 185/2001 của Brazil)
- Loại I: Các sản phẩm không có khả năng gây rủi ro cho người dùng hoặc sức khỏe cộng đồng và chỉ yêu cầu đăng ký tóm tắt ANVISA
- Loại 2 (Loại II): Các sản phẩm có khả năng gây rủi ro cho người dùng hoặc sức khỏe cộng đồng và cần phải đăng ký chính thức với ANVISA
- Loại 3 (Classe III): Sản phẩm có khả năng gây rủi ro rất cao cho người dùng hoặc sức khỏe cộng đồng cần phải đăng ký chính thức với ANVISA
- Nhóm 3-a (Loại IV): Mặt hàng yêu cầu kiểm tra tự động và phải đăng ký chính thức với ANVISA
Dưới đây là quy trình chứng nhận chung các sản phẩm thuộc danh mục Chứng nhận và Đăng ký ANVISA:
Dưới đây là Giấy chứng nhận ANVISA

Thông tin liên hệ để được tư vấn:
CÔNG TY TNHH GCL (HCM)
Hotline: 0393423091 | Hà Nội: 02473099929
Email: hcm@gclab.org | louise.vietnam@pcn-global.com
Văn phòng: Số 27, Đường 12, KDC Khang ĐIền, Phường Phước Long B, Thành phố Thủ Đức, Thành phố Hồ Chí Minh
Phòng thử nghiệm: Số 115, Ngõ An Phú 04, Phường An Phú, Thành phố Thuận An, Tỉnh Bình Dương.
CÔNG TY TNHH GCL (HCM)
Hotline: 0393423091 | Hà Nội: 02473099929
Email: hcm@gclab.org | louise.vietnam@pcn-global.com
Văn phòng: Số 27, Đường 12, KDC Khang ĐIền, Phường Phước Long B, Thành phố Thủ Đức, Thành phố Hồ Chí Minh
Phòng thử nghiệm: Số 115, Ngõ An Phú 04, Phường An Phú, Thành phố Thuận An, Tỉnh Bình Dương.










